第五章 金属的冶炼与利用
\[\S 5.1 \ 金属的性质\]一. 物理性质
(一)颜色
- 块状银白色,有金属光泽。粉末状黑色。
- 有一些特例,例如:$\ce{Au}$ 金黄色,$\ce{Cu}$ 紫红色或亮红色。
(二)硬度小。
(三)密度
- 密度小于 $4.5\ g/cm^3$:轻金属,如:$\ce{Mg,Al}$。
- 密度大于 $4.5\ g/cm^3$:重金属,如:$\ce{Hg,Pb,Ba,Cd,Cu}$。
(四)熔沸点
- 熔点最低:$\ce{Hg}$。
- 熔点最高:$\ce{W}$。
(五)金属特性
- 导电性:$\ce{Ag > Cu > Al}$,$\ce{Cu}$ 用作电线,电缆。$\ce{Al}$ 用作高压线。除金属外还有石墨具有导电性。
- 导热性:$\ce{Ag}$,用作暖瓶瓶胆。
- 延展性。
二. 化学性质
(一)与 $\ce{O2}$ 反应
- 镁在空气中燃烧:$\ce{2Mg + O2 \xlongequal{点燃} 2MgO}$。
- $\ce{Fe}$ 在 $\ce{O2}$ 中燃烧:$\ce{3F3 + 2O2 \xlongequal{点燃} Fe3O4}$。
- $\ce{Cu}$ 与 $\ce{O2}$ 反应
- 原理:$\ce{2Cu + O2 \xlongequal{\Delta} 2CuO}$。
- 现象:固体从紫红色变成黑色。
- 用途:除去混合气中的 $\ce{O2}$。
- $\ce{Al}$ 和 $\ce{O2}$ 反应
- 原理:$\ce{4Al + 3O2 \xlongequal{} 2Al2O3}$。
- 一层致密氧化膜。
- 现象:铝表面变暗。
- 应用:暖气片刷“银粉”即铝粉。
- 真金不怕火炼:金的化学性质稳定。
(二)与酸反应
- 分别将 $\ce{Mg,Zn,Fe,Cu}$ 加入稀硫酸中。
- 实验室制 $\ce{H2}$
- 原理:$\ce{Zn + H2SO4 \xlongequal{} ZnSO4 + H2 ^}$。
- 置换反应:$单质 + 化合物 \xrightarrow{} 化合物 + 单质$。
- $\ce{Zn + 2HCl \xlongequal{} ZnCl2 + H2 ^}$。
- $\ce{Mg + H2SO4 \xlongequal{} MgSO4 + H2 ^}$。
- $\ce{Mg + 2HCl \xlongequal{} MgCl2 + H2 ^}$。
- $\ce{2Al + 3H2SO4 \xlongequal{} Al2(SO4)3 + 3H2 ^}$。
- $\ce{2Al + 6HCl \xlongequal{} 2AlCl3 + 3H2 ^}$。
- $\ce{Fe + H2SO4 \xlongequal{} FeSO4 + H2 ^}$。
- $\ce{Fe + 2HCl \xlongequal{} FeCl2 + H2 ^}$。
- 现象:固体消失,产生气泡。镁:放大量热。铁:溶液从无色变成绿色。
- 反应后溶液质量一定增加。
- 常见金属活动性顺序:$\ce{K,Ca,Na},\boxed{\ce{Mg,Al,Zn,Fe}},\ce{Sn,Pb,(H),Cu,Hg,Ag Pt,Au}$,其中 $\ce{H}$ 指酸中的阳离子(氢离子)。
- 置换时活动性强的置换活动性差的。
- 相同条件下,常考 $4$ 种金属生成 $\ce{H2}$ 快慢:$\ce{Mg > Al > Zn > Fe}$。
- 生成 $\ce{H2}$ 多少:$m=\dfrac{m_金 \times 化合价}{相对原子质量}$,等质量 $4$ 种金属生成 $\ce{H2}$ 质量:$\ce{Al > Mg > Fe > Zn}$。
- 等质量 $\ce{Mg,Al}$ 分别于等质量、同浓度稀硫酸反应:

(三)与盐溶液反应
- 盐:$\ce{CuSO4,CaCO3,KNO3}$ 等。
- 在硫酸铜溶液中放入一个铁片。
- 原理(湿法炼铜的原理):$\ce{Fe + CuSO4 \xlongequal{} Cu + FeSO4}$。
- 现象:铁表面析出红色固体,溶液从蓝色变成浅绿色。
- 反应条件:前置后(金属活动性表中前面的置换后面的),盐比溶。
- 其它金属和盐溶液的反应
- $\ce{Fe + 2AgNO3 \xlongequal{} 2Ag + Fe(NO3)2}$。
- $\ce{Fe + Cu(NO3)2 \xlongequal{} Cu + Fe(NO3)2}$。
- $\ce{Cu + 2AgNO3 \xlongequal{} 2Ag + Cu(NO3)2}$。
- 反应生成物
- 一定量 $\ce{Fe}$ 放在 $\ce{AgNO3}$ 和 $\ce{Cu(NO3)2}$ 混合液中充分反应后过滤。
-
滤渣 滤液 $\ce{Ag}$ 可能有 $\ce{Ag+}$,一定有 $\ce{Cu^2+,Fe^2+}$ $\ce{Ag,Cu}$ 可能有 $\ce{Cu^2+}$,一定有 $\ce{Fe^2+}$ $\ce{Ag,Cu,Fe}$ 一定有 $\ce{Fe^2+}$ - 鉴别方法:除 $\ce{Fe}$ 用稀盐酸,除 $\ce{Cu}$ 用铜丝自沉。

- 反应后溶液质量不一定变大。
- 补充
- 检验或除去某金属,一般用酸。
- 比较金属活泼性,如 $\ce{Mg,Fe,Cu}$。使用 $\ce{Mg,Fe,Cu,HCl(aq)}$(不好)或 $\ce{Mg,FeSO4,Cu}$ 或 $\ce{MgSO4,Fe,CuSO4}$。
- 金属回收(铜)

三. 合金
(一)金属材料:纯金属,合金。
(二)合金
- 定义:一种金属跟其它金属或非金属溶合而成的有金属特性的物质。
- 合金性质
- 至少含 $1$ 种金属。
- 各元素均以单质形式存在。
- 优良性能:硬度大,熔点低,耐腐蚀性高。
- 铁的合金
- 生铁:$\ce{C}$ 含量:$2\ \% - 4.3\ \%$,硬度大。
- 钢:$\ce{C}$ 含量:$0.03\ \% - 2\ \%$,韧性好。
- 钢的合金:不锈钢加入 $\ce{Cr,Ni}$。
- 铜的合金
- 青铜:$\ce{Cu,Sn}$。
- 黄铜:$\ce{Cu,Zn}$。
一. 热分解法:$\ce{2HgO \xlongequal{\Delta} 2Hg + O2 ^}$。$\ce{HgO}$,氧化汞,红色固体。
二. 热还原法——炼铁
(一)原料:铁矿石,焦炭,石灰石,空气。
- 铁矿石
- 赤铁矿:$\ce{Fe2O3}$。
- 磁铁矿:$\ce{Fe3O4}$。
- 黄铁矿:$\ce{FeS2}$。
- 褐铁矿:$\ce{Fe2O3 * xH2O}$。
- 菱铁矿:$\ce{FeCO3}$。
- 优选条件:含铁量,不产生污染性气体。
- 还原剂
- $\ce{H2 \xrightarrow{} H2O}$,太贵。
- $\ce{C \xrightarrow{} CO2}$。
- $\ce{CO \xrightarrow{} CO2}$,存储不安全。
- 炼焦或干馏:煤在隔绝空气和加强热的条件下生成焦炭、炼焦油和焦炉煤气。
- 石灰石的作用:将矿石中的 $\ce{SiO2}$ 转变为炉渣(依据密度不同与生铁分开)。
(二)原理
- $\ce{C + O2 \xlongequal{点燃} CO2}$,提供热量。
- $\ce{C + CO2 \xlongequal{高温} 2CO}$,提供还原剂。
- $\ce{3CO + Fe2O3 \xlongequal{高温} 2Fe + 3CO2}$,其中 $\ce{CO}$ 是还原剂,$\ce{Fe2O3}$ 是氧化剂。
- 还原剂:有还原性(得到氧元素),被氧化,发生氧化反应。
- 氧化剂:有氧化性(提供氧元素),被还原,发生还原反应。
(三)产品:生铁。
(四)设备:高炉。
三. 实验室模拟炼铁
(一)原理:$\ce{3CO + Fe2O3 \xlongequal{} 2Fe + 3CO2}$。
(二)装置:
(三)现象
- 玻璃管内红棕色固体变成黑色。
- 澄清石灰水变浑浊。
- 尾部气体能燃烧,产生蓝色火焰。
(四)注意
- 先通 $\ce{CO}$ 一段时间,再给固体加热。目的:排净装置内空气,防止 $\ce{CO}$ 与空气混合物在加热时发生爆炸。
- 继续通 $\ce{CO}$ 至装置冷却。目的:防止生成的金属被氧化、液体倒吸。
- 澄清石灰水作用:检验并吸收 $\ce{CO2}$。
- 尾部酒精灯作用:点燃 $\ce{CO}$,防止造成空气污染。如何处理尾气:在装置尾部放一燃着的酒精灯点燃 $\ce{CO}$。在玻璃管后接一个空瓶的作用:安全瓶,目的:防止液体倒吸,玻璃管炸裂。
- 改装

- 作用:检验并吸收 $\ce{CO2}$,收集 $\ce{CO}$。
- 反应条件
- 气体炼铜是加热,其余均为高温。
- $\ce{3H2 + Fe2O3 \xlongequal{高温} 3H2O + 2Fe}$。
- $\ce{4H2 + Fe3O4 \xlongequal{高温} 4H2O + 3Fe}$。
- $\ce{H2 + CuO \xlongequal{\Delta} H2O + Cu}$。
- $\ce{3C + 2Fe2O3 \xlongequal{高温} 3CO2 ^ + 4Fe}$。
- $\ce{2C + Fe3O4 \xlongequal{高温} 2CO2 ^ + 3Fe}$。
- $\ce{C + 2CuO \xlongequal{高温} CO2 ^ + 2Cu}$。
- $\ce{3CO + Fe2O3 \xlongequal{高温} 3CO2 + 2Fe}$。
- $\ce{4Co + Fe3O4 \xlongequal{高温} 4CO2 + 3Fe}$。
- $\ce{Co + CuO \xlongequal{\Delta} CO2 + Cu}$。
- 反应类型
- $\ce{H2}$ 和 $\ce{C}$ 属于置换反应,$\ce{CO}$ 不属于基本反应类型。
- $置换反应\begin{cases}溶液\begin{cases}金属与酸反应\ 金属与盐反应生成另一种金属\end{cases}\ 非溶液:\ce{H2}或\ce{C}与化合物反应生成金属\end{cases}$
- 玻璃管中固体质量减少,减少的是反应的氧元素质量(可用于计算)。
- 以 $\ce{Fe}$,稀 $\ce{H2SO4}$,$\ce{CuO}$ 为原料制铜
- $\begin{cases}第一步:\ce{Fe + H2SO4 \xlongequal{} FeSO4 + H2 ^}\ 第二步:\ce{H2 + CuO \xlongequal{\Delta} Cu + H2O}\end{cases}$
- $\begin{cases}第一步:\ce{CuO + H2SO4 \xlongequal{} CuSO4 + H2O}\ 第二步:\ce{Fe + CuSO4 \xlongequal{} FeSO4 + Cu}\end{cases}$
- 选用第二种方法的优点:安全,节能,操作简便。
四. 电解法炼铝
点解熔融的 $\ce{Al2O3}$,原理:$\ce{2Al2O3 \xlongequal{通电} 4Al + 3O2 ^}$。
五. 炼钢(百炼成钢)
原理:$\ce{C + O2 \xlongequal{高温} CO2}$。工业上炼钢用纯氧,提高氧气浓度,使生铁中的碳充分反应。
\[\S 5.3 \ 金属的防护与回收\]一. 防护
(一)铁生锈的条件
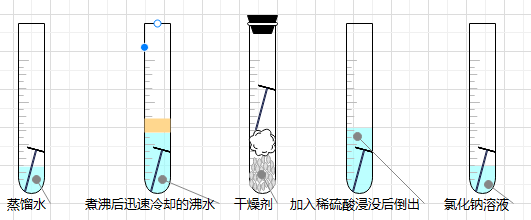
- 结论:是铁、氧气、水共同作用的结果。
- 铁锈:红褐色混合物。主要成分:$\ce{Fe2O3}$,具有疏松多孔结构,铁生锈属于缓慢氧化,放热。
(二)防锈原理
- 隔绝氧气,如涂油、喷漆、镀锌。
- 保持干燥,如使用后立刻擦干。
- 改变内部结构,如形成不锈钢。
(三)除锈方法
- 物理方法:砂纸打磨,除去金属表面的氧化膜。
- 化学方法:加酸
- $\ce{Fe2O3 + 6HCl \xlongequal{} 2FeCl3 + 3H2O}$。
- $\ce{Fe2O3 + 3H2SO4 \xlongequal{} Fe2(SO4)3 + 3H2O}$。
- 现象:固体减少,溶液从无色变成黄色。
(四)应用
- 食品双吸剂。
- 暖宝宝热敷袋——$\ce{Fe}$ 粉,木炭粉,活性炭,$\ce{NaCl}$,$\ce{H2O}$。
- 放热原理:氧化反应。
(五)$\ce{Cu}$ 生锈条件
- $\ce{2Cu + O2 + H2O + CO2 \xlongequal{} Cu2(OH)2CO3}$。
- 除铜锈:$\ce{Cu2(OH)2CO3 + 4HCl \xlongequal{} 2CuCl2 + 3H2O + CO2}$。